adiabatikus folyamatok
Fizika> adiabatikus folyamatok
Adiabatikus utalni kell minden olyan folyamatot. nélkül megvalósított nyereség vagy veszteség hő a rendszeren belül.
tanulási feladat
- Mérje fel a környezetet, amelyben az izotermikus folyamatok játszódnak le.
A főbb pontok
- Adiabatikus folyamatok merülnek fel, ha a tartály hőszigetelt falak vagy járunk el rövid idő alatt.
- Bővülő adiabatikus ideális egyatomos gáz, működő közép-, belső energiát kell csökkenteni.
- Izotermikus folyamatot lehet tekinteni, mint az ellenkezője az adiabatikus. Az első hőcsere végbemegy lassan, hogy a hőmérséklet állandó marad.
- Boyle-törvény - ideális gáz nyomása van elhelyezve a fordított arányban mennyisége a stabil hőmérsékletet.
- Az ideális gáz - hipotetikus koncepció, ahol; molekulák mentes kontakt és áteső elasztikus dudorok egymással és a falak a tartály.
- Váltvaforgató - a képesség, hogy visszatérjen eredeti állapotába használata nélkül szabad energia és entrópia növekszik.
Izoterm folyamat - változtatni rendszer, ahol a hőmérséklet állandó marad: AT = 0. Általában ez akkor történik, amikor a rendszer érintkezik egy külső hőtároló tartály (meleg fürdő), és a változások lassú ahhoz, hogy a rendszer tudja állítani a hőmérséklet a tartály útján hőcsere.
Adiabatikus folyamat alapja az a tény, hogy a rendszer és a környezet nem hőcserét (Q = 0). Azaz, egy izoterm folyamat? T = 0, de Q ≠ 0, és az adiabatikus - AT ≠ 0, de Q = 0.
Az ideális gáz izoterm
A termék a nyomás és térfogat (PV) jár el az ideális gázokra stabil, ha a gáz megmarad izoterm körülmények között (Boyle-törvény). De nem volt olyan eset, amikor a termék működik, mint a PV exponenciális. A nagysága állandó nRT, ahol n - móljainak a száma a gáz jelen, és R - az ideális gázállandó. Azaz, a ideális gáztörvény PV = nRT. Ez azt jelenti, hogy
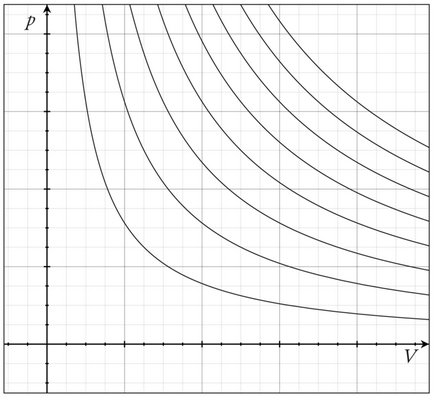
Több izotermák az ideális gáz diagrammePV
kiszámítása
A termodinamika, által végzett munka a gázt állami B-be, látható, mint:
A szemben a izoterm folyamat megegyezik a szerves nyomás és volumen terület jelzi kék. P = T használunk egy stabil, és tudjuk:
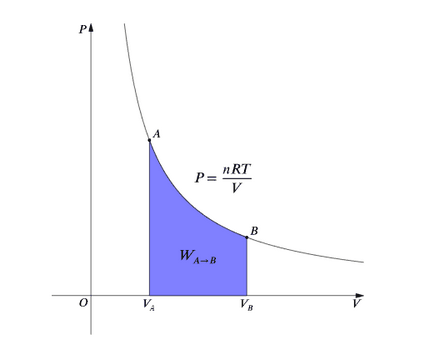
A kék terület mutatja munkát végez a gáz izotermikus expanzió időszaka változások
Ha a hőmérsékletet stabil, a belső energia a rendszer is stabil, ezért Au = 0. A termodinamika első főtétele, hogy Q = -W ugyanazon izotermikus folyamat.