Mi az elektron konfiguráció
Elektronikus atom konfigurációja - a elektronok eloszlását az energiaszint és sublevels. A hagyományos felvételi elektronikus konfiguráció használt elektronikus képletek.
Elektronikus minősül képlet elvén alapuló minimális energia és Pauli elveket, az alábbi algoritmus:
minden egyes pontja az elektron energia szinten számot a számértéke a fő kvantum n száma (lásd a 3.6 táblázat.);
jelzik energia szintalatti keresztül betűkkel orbitális kvantum szám l (lásd 3.6 táblázat.);
jelzi a teljes száma az elektronok az energia szintalatti egy kis számban, ami meg van írva a jobb felső fölött alfabetikus karakter orbitális kvantum szám l.
Például, a rögzítési 1s1 - e egy olyan formula, amelyben kis számú jelöli egy elektron, amely az első energiaszint (n = 1), s-alréteg (L = 0). Következésképpen, az elektron képletű tükrözi elektronikus konfigurációs elem hidrogénatom H, ahol van egy egyedi elektron.
Elektronikus konfigurációs 21Sc tagja szkandium atom, ahol van egy elektron 21 felírható e 1s22s22r63s23r64s23d1 képletű vagy olyan más formában, összeadásával összes sublevels a megfelelő energia szintet:
Elektron képletű 21Sc atomja látható, hogy az elektron héj tartalmaz két elektron s-alréteg az első energiaszint (1S2), két elektron s-szintalatti és hat elektronok a p-alréteg második energiaszintre, azaz nyolc elektronok a második szinten ( 2s22r6), két elektron s-alréteget, hat elektronok a p-alréteget, egy elektront a d-szintalatti harmadik energiaszintre, azaz kilenc elektronok a harmadik energiaszint (3s23r63d1) és két elektron s-negyedik alréteg energia urs I (4s2).
Néha, hogy megkönnyítse az elektronikus képletek helyett belső elektrondonor rétegek atom szimbólum írva zárójelben az inert tagja. A legközelebbi technika és a szkandium 21Sc inert elem Argon 18Ar azonban kondenzálva képletű E a forma szkandium
Egy atom képezhet elektron-folyamatábra, amely megmutatja a elhelyezése elektronok a kvantum sejtekben jelző pályák. Tekintettel a elvének minimális energia kerül alján az első sejt-orbitális energiaszintet (n = 1), a fölötte - a második (n = 2), majd - a harmadik (n = 3), stb elektron folyamatábrája egy atom szkandium 21Sc alábbiak szerint ábrázolható:
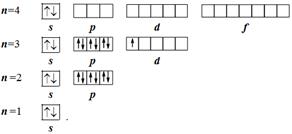
Használat és csökkentett elektron folyamatábrák, amelyek azt mutatják, egy kvantum cella csak külső elektronikus rétegek. Számuk határozza meg a helyét képező elektron, azaz, hogy az elektron amely kitölti az utolsó elektron héj egy atom. A szkandium atom képező elektron (№ 21) található, a 3D-alréteget, így kondenzált elektron folyamatábra kell mutatni két szinten:
Attól függően, hogy mi az energia szintalatti elektron belép alkotó, az elemek vannak osztva s-, p-, d-, és F-E-család ötvözi s-, p-, d-, és F-elemek, ill.
A elemek alkilcsoport, amely tele s-alréteg külső energia szinten, az úgynevezett S-elemek.
Például, a lítium és a berillium a s-elemek:
A elemek alkilcsoport, amely tele van a p-alréteg a külső réteg, az úgynevezett p-elemek.
Például, az elemek a szén és a neon p-elemek:
A elemek alkilcsoport, amely tele d-második alréteg külső oldalán az energia szinten, az úgynevezett D-elemek.
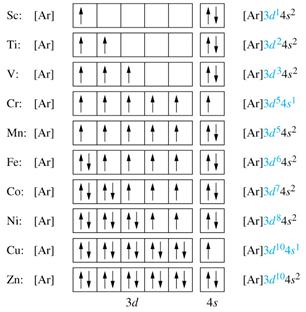
Például, tíz elemek - a szkandium, hogy a cink - családjába tartoznak a D-E és D-elemek, mert a elektronok alkotó atomok a d-szintalatti:
A elemek az atomok, amely tele van F-alréteg külső oldalán a harmadik szint, az úgynevezett F-elemek.
Például, az elemek cérium és protaktínium F-elemek:
Példa 3.11. Tedd e-mail általános képletű és az elektron - folyamatábra két külső energia szintjét az ilyen részecskék: a) Ar atomok; b) S2- ion; c) ion K +; g) ion Zn2 +. Határozza izoelektronos részecskék.
Határozat. Izoelektronos nevezett részecskék alkalmazása, amelyek ugyanazt az elektronikus konfiguráció, így a szerkezet által leírt ugyanazon képletek és ugyanazt az elektronikus elektron diffrakciós mintákat.
a) elem argon sorszámát (18) azt jelzi, hogy Ar atom 18 elektronok; helyen, a harmadik időszakban - a jelenléte a három energiaszintek, hogy a nyolcadik csoport - száma külső elektron azonos szinten nyolc, és a fő alcsoport (VIIIA) azt jelzi, Ar tartozó p-elektron család. Ennélfogva, az elektron és elektron képlet folyamatábra a két külső réteg argon atomok elem formájában
b) száma a kémiai elem Kén S 16, így az elektron képletű S atom
Azonban, ion töltése (-2) azt mutatja, hogy az ion S2- két elektron megelőzve S, azaz olyan atomot 16 + 2 = 18. Mivel az azonos számú elektronok atom és Ar ion izoelektronikus S2- részecskék, és ugyanolyan képletű és az elektronikus katód folyamatábrák:
c) száma a kémiai elem Kálium - 19, SO, K atom tartalmazza 19 elektronok és ionok K + - egy elektron kevesebb (19-1 = 18). Ennélfogva, a K + ion izoelektronos tekintetében részecske atom, és Ar-ion S2-, ami nyilvánvaló a képlet e K + ion és az elektron - grafikai program:
g) Ion Zn2 + (№ 30) két elektron kevesebb, mint egy cinkatomot, így a Zn2 + ion mennyisége elektronok 30-2 = 28. Elhelyezésüket az elektron héj által leírt képlet E
és elektron folyamatábra két külső energia szintjét a formája
Ezért, Zn2 + ion nem van izoelektronos részecske Ar atom és a K + és a S2 ~ ionokat.
Kulcs szavak és kifejezések
Mi az elektronikus konfiguráció az atomok, elektronok képlet?
Milyen elemeket nevezik: a) s-elemek; b) p-elemek; a) D-elemek;
Feladatok az önálló munkavégzésre
Mi elektronikus képletű megfelel atom Br:
a) 1s22s22r63s23r64s24r5; b) 1s22s22r63s23r64s23d104r5; c) 1s22s22r63s23r64s24r65s24d5; g) 1s22s22r63s23r64s24r65s24d4?
Hogy az elektronikus képletek atomok atomszámai elemek: a) 5; b) 7; c) 9; d) 12; d) 16; e) 21; g) 23; h) 30.
Utolsó elektron (képző) elem ilyen atom ismertetik kvantumszámok: n = 4, l = 1, m = 0, s = + 1/2. Mi az elem: a) Ga; b) Ti; a) Ge; g) Ca?
Utolsó elektron (képző) elem ilyen atom ismertetik kvantumszámok: n = 3, l = 2, m = - 1, s = -1/2. Mi ez az elem: a) Fe; b) Co; a) Ni; g) Na?
Utolsó elektron (alkotó) az az atom az elem által leírt kvantum számok:
a) n = 3, l = 1, m = - 1, s = - 1/2; b) n = 2, l = 0, m = 0, s = + 1/2; a) n = 3, l = 2, m = + 2,
s = + 1/2; g) n = 3, l = 0, m = 0, s = + 1/2; d) n = 3, l = 0, m = 0, s = - 1/2.
Tedd egy elektronikus képletű minden egyes eleme az atom.