Elektronikus konfigurációja
Az elektronikus konfigurációja az elem eloszlása elektronok annak atomok felvétel kagyló, subshells, és pályák. Az elektronikus konfiguráció általában írt atomot tartalmaznak a alapállapotú. Elektronikus atomi konfiguráció, amelyben egy vagy több elektron gerjesztett állapotot nevezik izgatott konfiguráció. Hogy meghatározzák a konkrét konfigurációját az elektronikus elem alapállapotú, a következő három szabály: 1. szabály: töltés elve. Elve szerint a töltés, az elektronok a alapállapotú atomi van töltve a szekvenciában növekedését orbitális energiaszintet. Alacsonyabb energia pályák mindig tele először.
hidrogénatom; atomszámú = 1; elektronok száma = 1
Ez az egyetlen elektron hidrogénatom kell elfoglalnia, s-orbitális a K-span mintegy mert az összes lehetséges pályák ez rendelkezik a legalacsonyabb energia (lásd. Ábra. 1,21). Electron ezen s-orbitális nevezzük ls-elektron. A hidrogén az alapállapotú egy elektronikus konfiguráció IS1.
2. szabály: Pauli-elv. Ezen elv szerint, minden orbitális nem lehet több, mint két elektront és csak akkor, ha azok ellentétes pörgetés (spin egyenlőtlen számok).
lítium; Atomic szám = 3; elektronok száma = 3
Orbital a legalacsonyabb energia az 1s-orbitál. Meg lehet venni csak két elektron. Ezek az elektronok kell egyenlőtlen vissza. Ha jelöljük a spin +1/2 nyíl felfelé és spin -1/2 nyíl mutat lefelé, a két elektron ellentétes (antiparallel) forog ugyanolyan orbitális sematikusan egy rekord (ábra. 1,27)
Az egyik orbitális nem lehet két elektron azonos (párhuzamos) forog:
A harmadik elektron egy atom lítium kell elfoglalni orbitális energia a következő legalacsonyabb orbitális, azaz 2c-orbitális. Így, lítium elektronikusan konfigurálva Is22s1.
3. szabály: Hund szabály. E szabály értelmében, a tölteléket kezdődik pályák egyik alburok elektronok párhuzamos egységes (egyenlőségjel) forog, és csak egyszeri elektronok elfoglalják az összes pályák előfordulhat végső töltési pályák pár elektronok ellentétes forog.
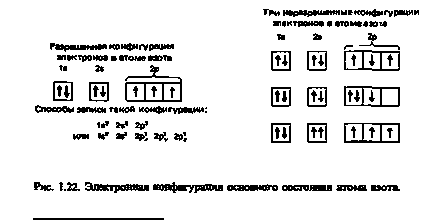
nitrogén; atomszámú = 7; elektronok száma = 7 Nitrogén rendelkezik elektronikus konfigurációs ls22s22p3. Három elektronok a 2p alhéj kell helyezni, egyenként mindhárom 2p pályák. Ugyanakkor, mind a három elektron párhuzamosan fel kell pörgetés (ábra. 1,22).
Táblázat. 1.6 ábra az elektronikus konfiguráció a elemek atomszáma az 1-20.
1.6 táblázat. Az elektronikus konfiguráció az alapállapot számára elemek atomszáma 1-20
