Elektronikus konfiguráció 2
Az elektronikus konfiguráció általában írt atomot tartalmaznak a alapállapotú. Annak megállapításához, a konfiguráció az elektronikus elem, a következő szabályokat kell alkalmazni:
- töltési elv. Elve szerint a töltés, az elektronok a alapállapotú atomi van töltve a szekvenciában növekedését orbitális energiaszintet. Alacsonyabb energia pályák mindig tele először.
- Pauli-elv. Ezen elv szerint, minden orbitális nem lehet több, mint két elektront és csak akkor, ha azok ellentétes pörgetés (spin egyenlőtlen számok).
- Hund szabály. E szabály értelmében, a tölteléket kezdődik pályák egyik alburok elektronok párhuzamos egységes (egyenlőségjel) forog, és csak egyszeri elektronok elfoglalják az összes pályák előfordulhat végső töltési pályák pár elektronok ellentétes forog.
A szempontból a kvantummechanika, az elektron konfiguráció - egy teljes listát az egy-elektron hullám funkciók. amelyek megfelelő pontossággal lehet, hogy egy teljes hullám funkciót atom (a self-mező).
Általánosságban elmondható, az atom, szerves rendszer, lehetőség van arra, hogy teljes mértékben leírni csak a teljes hullám funkciót. Azonban az ilyen leírás gyakorlatilag lehetetlen a hidrogénatomok nehezebb - a legegyszerűbb az összes atomok kémiai elemek. Kényelmes közelítő leírását - módszer önkonzisztens területen. Ebben az eljárásban, akkor a koncepció a hullám függvény minden egyes elektron. A hullám funkciója az egész rendszer van írva, mint rendesen simmetrizovanoe termékből egy elektron hullám funkciókat. Kiszámításakor a hullám funkciója az egyes elektron területén az összes többi elektron számít, mint a külső potenciális. ami függ viszont a hullám funkciók a többi elektronokat.
Ennek eredményeként a módszer alkalmazásával önkonzisztens mező kapott komplex rendszer nemlineáris Integro-differenciálegyenletek. ami még mindig nehéz megoldani. Azonban a ellentmondásmentes téregyenleteket forgásszimmetrikus az eredeti probléma (vagyis azok gömbszimmetrikus). Ez lehetővé teszi, hogy teljes mértékben osztályozza az egy elektron hullám funkciók teszik ki a teljes hullámfüggvény az atom.
Először is, mint minden központosán szimmetrikus potenciál, a hullám funkció önkonzisztens mező lehet jellemezni a kvantum száma a teljes perdület l, és a kvantum száma perdület vetítési bármely tengelyen m. A hullám funkciók különböző m értékek megfelelnek az ugyanaz az energia szinten, azaz. E. degenerált. Emellett egyetlen energia szint megfelel az államok eltérő elektron spin vetítés minden tengelyen. Teljes teljesítmény egy adott szint 2 (2 l + 1) a hullám funkciók. Továbbá, egy adott értéket perdület sorolható az energiaszintet. Ennek analógiájára a hidrogénatom számozási elfogadott az energia szintjét kezdve L n = l + 1. A teljes listát a kvantum számú elektron hullám funkciók, amelyek lehet, hogy a hullámfüggvény az atom, és az úgynevezett elektronszerkezet. Mivel minden degenerált a kvantum száma m, és a hátán, elég ahhoz, hogy jelezze a teljes elektronok száma egy állam az adatok n. l.
Megfejtése az elektronikus konfiguráció
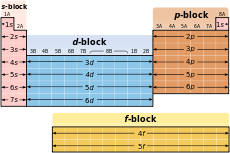
Táblázat elektronszerkezet
Történelmi okokból, a képlet az elektron konfiguráció kvantum szám l van írva latin betűkkel. Az állam L = 0 jelöli s. o. l = 1. d. L = 2. f. L = 3. g. L = 4, majd ABC sorrendben. Ahhoz, hogy a bal oldalon a szám l írási n szám. és a tetején a szám l - elektronok száma egy állami adatokkal és N L. Példa 2 s 2> megfelel a két elektront az állam, ahol n = 2. L = 0. Mivel a praktikus kényelem (lásd. Aufbau elv) teljesen elektronikus konfiguráció képletű írási szempontjából növekvő sorrendjében a kvantum n szám. majd kvantum szám l. például s 1 s 2 február 2 február március 6 p s p 2 március 3 2s ^ 2p ^ 3S ^ 3p ^>. Mivel az ilyen több redundáns rögzítési, néha rövidítve képletű 1 2 s 2 s 2 s 3 június p 2 p 3 2s ^ p ^ 3S ^ o ^>. t. e. csökkentheti az n szám, ahol lehetőség van kitalálni a feltételeket a rendelési szabályokat.
Periodikus törvény, és a szerkezet az atom
Minden részt vettek kérdésekben atomi szerkezet minden vizsgálatok alapján az eszközöket, amelyek arra szolgálnak, hogy azokat a periodikus törvény. nyitott vegyész D. I. Mendeleevym; Csak az ő megértése a törvény a fizika és a matematika használják, hogy értelmezze a kapcsolatot mutatott nekik a „nyelv” (de ismert meglehetősen ironikus aforizma George. W. Gibbs e témában [1]), de ugyanakkor, izolált vegyészek tanulmányozni anyagot, minden tökéletes, az előnyök és a sokoldalúság a járműveket sem a fizika vagy a matematika, persze, hogy felépítse a kutatás nem képes erre.
A kölcsönhatás képviselőinek e diszciplínák fordul elő a jövőbeli fejlődése témát. A megnyitó a másodlagos periodicitás E. V. Bironom (1915), adott egy másik dimenziót a problémák megértésének kapcsolatos jogszabályok szerkezetét az elektron pályák. C. A. Shchukarev. tanuló E. V. Birona és M. S. Vrevskogo. az egyik első a korai 1920-as években azt javasolta, hogy „a frekvencia egy tulajdonság velejárója a sejtmagban.”
Ezzel teljes egyértelműség megértésében oka a másodlagos jelentése nem olyan messze, van kilátás ebben a kérdésben, azt értjük, hogy az egyik fő oka ennek a jelenségnek a nyílt S. A. Schukarevym kaynosimmetriya - az első megnyilvánulása egy új orbitális szimmetria (másokra . görög καινός - új és régi görög συμμετρία - szimmetria. "kaynosimmetriya", azaz "új szimmetriáját"). Kaynosimmetriki - hidrogén és a hélium. amelynek orbitális s ott. - elemek a bór neon (orbitális - p), - az elemek az első átmenetifém sorozat szkandium cink (orbitális - d), és - a lantanidák (A kifejezés S. A. Schukarevym javasolt aktinidáknak) (orbitális - f). Mint ismeretes, az elemeket, amelyek kaynosimmetrikami, sok tekintetben, fizikai és kémiai tulajdonságok eltérnek a más elemek tartozó, azonos alcsoportba.
Magfizika lehetővé tette, hogy távolítsa el a vitát társított „tilalom” Lyudviga Prandtlya [2]. Az 1920-as évek ugyanazon S. A. Schukarev megfogalmazott általában izotóp statisztikák, amely megállapítja, hogy a természetben nem lehet két stabil izotópok a tömegszáma azonos, és felelős a atommag, eltérő egy - az egyik közülük kell lennie a radioaktív. Teljes formájában, ezt a mintát szerzett 1934-ben, köszönhetően az osztrák fizikus J. Mattauhu, és kap a megfelelő nevet tilalmat Mattauha-Shchukarev. [3] [4]