adiabatikus folyamat
Adiabatikus (adiabatikus) folyamat egy folyamat, amely a termodinamikai rendszer hiányában a hőcsere a környező szervek, azaz a priQ = 0.
UslovieQ = 0 szükséges, de nem elégséges feltétele, adiabatikus folyamat. Ez az állapot lehet megfelelnek a folyamatok, amelyek egyes részei a rendszer megkapja a hőt, és a másik ad, úgy, hogy a termelt összes hő (adott rendszer lehet nulla. Amikor adiabatikus folyamat rendszert bármely infinitezimális részek nem kap, és nem ad hőt. Gyakorlatilag adiabatikus folyamatok előforduló elég gyors, és a tökéletes szigetelési rendszerek. Mivel az adiabatikus folyamat
a hőt a gáz a folyamat során,
A termodinamika első főtétele az adiabatikus folyamat a következő:
PDV = -
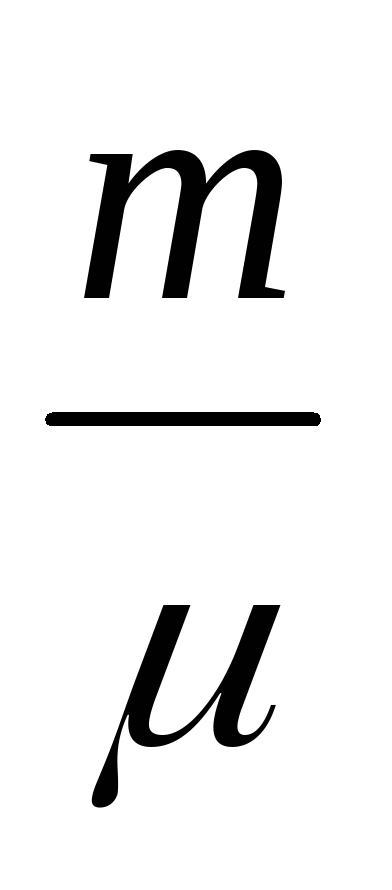
pv =
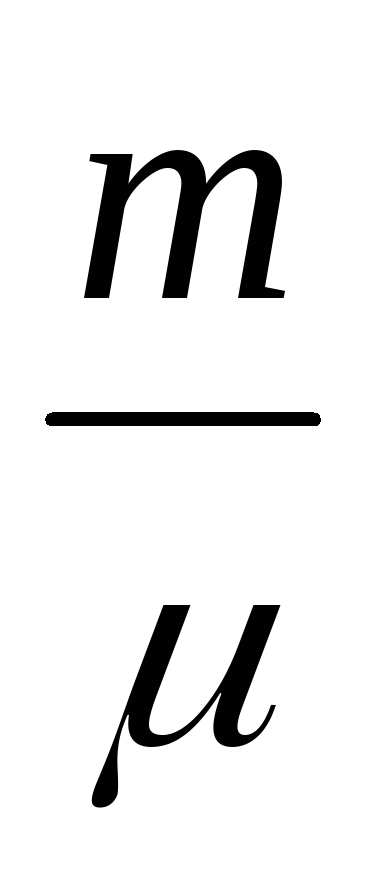
PDV + VDP =
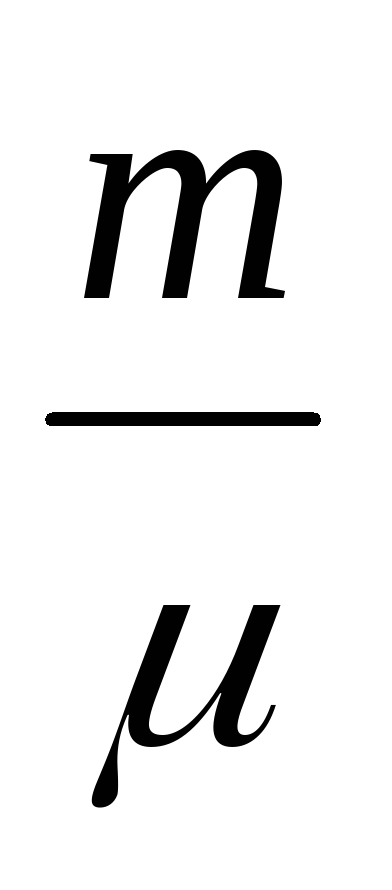
Osszuk egyenlet (2) az (1) egyenlet
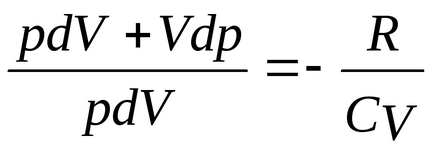
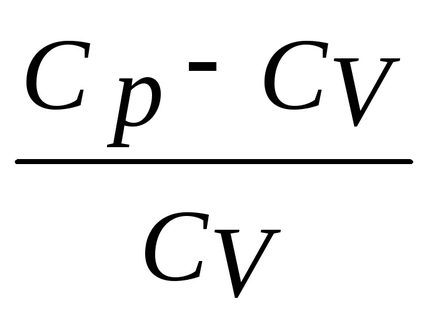
feltéve, hogy
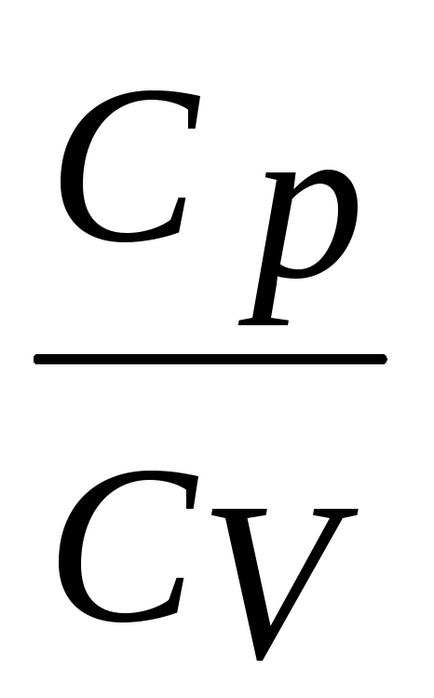
Egyenlet adiabatikus folyamat formájában
R1v1 = r2v2 vagy p V = const
gde- adiabatikus index. Lépéshez a P és T peremennymTiVili kizárják az utolsó egyenlet nyomás illetve a térfogat Mengyelejev-Clapeyron egyenlet. Aztán kapunk:
Tv-1 = const; vagy tp1- = const.
Között az adiabatikus és magában gyors folyamatok, ha az idő, amely alatt a változás gáz térfogata lényegesen kisebb, mint a szükséges időt, hogy létrehozza a termikus egyensúlyt a környező szerveket.
Működés alatt adiabatikus folyamat miatt előfordul, hogy a változás a belső energia
Átírjuk az egyenletben formájában
Az egyenlet a adiabatikus TV-1 = const, cserélje aránya
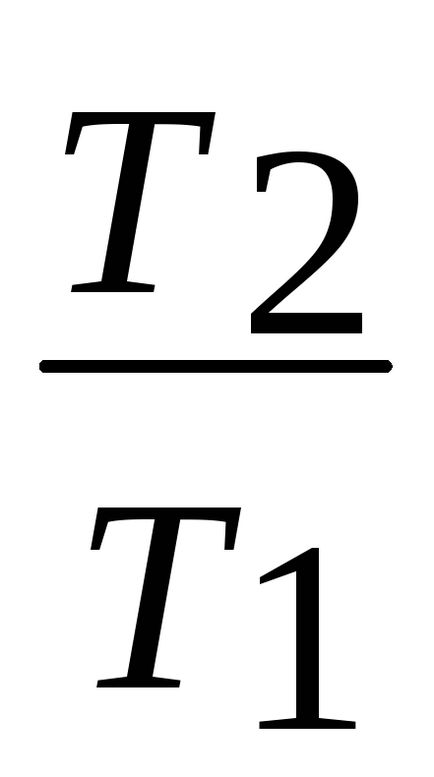
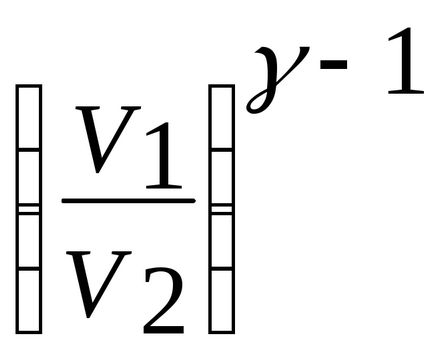
Tehát kakR = Cp-CVI van
Amikor adiabatikus gázt az expanziós munka végezzük csökkenti a belső energiidU = -Ai gáz hőmérsékletét csökkentjük; adiabatikus kompresszió növeli a belső energiája a gáz, hőmérséklete emelkedik.
Mivel az adiabatikus gázt kompresszió, a hőmérséklet emelkedik, a gáz nyomása gyorsabban növekszik, mint az izotermikus kompresszió. Hőmérsékletének csökkentése a gáz adiabatikus tágulása okoz a gáz nyomása, hogy gyorsabban csökken, mint az izotermikus expanzió.
Rendszer állapot. Reverzibilis és irreverzibilis folyamatok.
Rendszer szervek, vagy egyszerűen csak egy olyan rendszert hívunk COBOL-kupnost szervek. Egy példa rendszer egy folyékony és egyensúlyban van a gőzével. Különösen, a B Stem állhat egyetlen test.
Bármely rendszer lehet a különböző államok különböző hőmérséklet, nyomás, térfogat, és így tovább. E. Hasonlóság-WIDE mennyiségek jellemző a rendszer állapotát, az úgynevezett paraméterek állapotát.
Nem mindig a paraméter egy bizonyos értéket. Ha például, a hőmérséklet különböző pontjain a test változik, a test nem lehet rendelni egy meghatározott érték parametraT.V ebben az esetben az úgynevezett nem egyensúlyi állapotban. Mert nem egyensúlyi állapotok meghatározó paraméterek a rendszer állapotát, nincs konkrét értékeket.
Ha egy ilyen szervezet van szigetelve más szerveket, hogy maga a hőmérsékletet beállítva és megkapja ugyanazt az összes pontot a T értéke - a test belép egy egyensúlyi állapot. Ez az érték a T nem változik mindaddig, amíg a test nem kell kivonni a egyensúlyi állapot-Nogo befolyása kívülről.
Ugyanez vonatkozik az egyéb paraméterek, például intézkedéseket kell megtenni davleniyar.Esli gáz zárt hengeres-ég edénybe zárt szorosan záró dugattyú és a dugattyú csúszó kezdeni gyors, majd alatta képez gázpárna, a nyomás, amelynek több, mint a többi gázmennyiség. Következésképpen a gáz ebben az esetben lehet jellemezni egy meghatározott érték davleniyar és állapot lesz egyenlőtlenül tavasszal. Azonban, ha a stop a dugattyú mozgásának, a nyomás különböző pontjain a mennyiség és egy vonalban a gáz belép egy egyensúlyi állapotot.
Hasonló a helyzet találkozunk, ha a telepítés és a-SRI közötti egyensúly folyadék és gőz, zárt edényben. A gőz a folyadék feletti képződik bepárlással - mintegy Cess, amely abban áll, hogy a folyékony molekulák nagy sebességgel hagyja el a folyadék felszínén. De néhány molekula, a folyékony balra kaotikus mozgás zhenii juthat vissza, és ez gyakrabban előfordul, annál az előállított gőzt. Az egyensúly a folyadék és annak gőz akkor jelentkezik, ha a molekulák száma elhagyó folyadék egységnyi idő egyenlővé válik a molekulák száma, visszatérő a gőz ott. Vapor telítődik, és utána nincs makroszkopikus rendszer változásai nem fog létrejönni, - nyomás és hőmérséklet állandó marad. Hod Nako hozama molekulák a folyadék és a visszatérését a pro-pár folytatódik, és egyensúlyba hozás után. Ebben az esetben lehetséges, hogy egy egyensúlyi állapot részein pár térfogata sűrűsége egy kissé eltérhet az átlagos, m. E. A sűrűsége telített gőz.
Ezek a példák azt mutatják, a két mozzanat az egyensúlyi állapot. Először is, a koncepció a termodinamikai egyensúly bizonyos idealizáció, mert szigorúan véve, az állam paramétereket egyensúlyi nem állandó marad, de úgy érzi, kis rezgések közel egyensúlyi (átlag) értékeket. Az ilyen rezgések, ahogy fentebb említettük, nazyvayutsyafluktuatsiyami.Vo Másodszor, termodinamikai egyensúly csak azt mondhatom, hogy abban az esetben, ha a részecskék száma, amelyek a rendszert, nagyon nagy.
Így az egyensúlyi állapot a rendszer neve, olyan állapotot jelez, amely az összes paramétert a rendszer bizonyos értékeket, amelyek továbbra is állandó külső körülmények állandó végtelenségig.
Az átmenet folyamata egy egyensúlyi állapotba egyensúlyi egyenlő nevezett relaxációs folyamat vagy pro száz relaxációs. Töltött idő egy ilyen átmenet az úgynevezett relaxációs idő. A relaxációs idő vesszük azt az időt, amely a kezdeti-nenie Az eltérés bármilyen mennyiségben az egyensúlyi érték csökken Veraz. Minden paraméter a rendszer saját ideje relak-dély. A legnagyobb ezek közül alkalommal szerepet tölt időt pihenésre-CIÓ rendszert.
De amikor a mérleg már létrejött, a rendszer nem tudja, mivel a tapasztalat azt mutatja, hogy maga visszatér az eredeti egyensúlyi állapot. Más szóval, a változás-CIÓ átesett a rendszert, hogy átmenjen az egyensúlyi állapot, nem fordulhat elő az ellenkező irányba anélkül, hogy a külső kosár-tevékenységet.
Például, ha két érintkező szervek volt az első hőmérséklet-különbség, valamint magukra maradtak, a végén, mindkét szerv igazodik hőmérsékleten. Azonban a fordított folyamat - növeli a hőmérséklet-különbség közöttük - anélkül, hogy külső befolyás nem fordul elő.
Maga a gáz mindig egyenletesen oszlik el a térfogata a tartály és ennek az állapotnak felel meg, egyensúlyt. De a földgáz sosem felhalmozódnak egy része a hajó több együttes lichestve (nagyobb sűrűségű), mint a másik, anélkül, hogy az intézkedés a külső erők.
Hasonlóképpen, ha bevezetjük két gáztartály, akkor összekeverednek miatt kölcsönös diffúzió, úgy, hogy a keverék lenne mindenütt ugyanaz. Ez lesz az egyensúlyi állapotot. Annak érdekében azonban, hogy újra osztani ezeket a gázokat trebuetsyazatratit nagy erőfeszítéseket kívülről.
Ezek a példák mutatnak, hogy egy fontos jellemzője a pro-folyamatok előforduló molekuláris rendszerek - a ihneobratimost.Etim molekuláris folyamatok eltérnek tisztán mechanikus, amelyeket az jellemez, strogayaobratimost.
Váltvaforgató protsessomnazyvaetsya egy ilyen változás a rendszer állapota (vagy egyetlen szerv), amely, ha végzett fordított irányban, visszatér eredeti állapotába, így a rendszer ment keresztül ugyanazon a köztes állapot, mint a közvetlen eljárással, de fordított sorrendben, és az állam kívüli szervek rendszere változatlan maradt.
Obratimymiyavlyayutsya minden mozgások figyelembe venni me-mechanika, és kivéve azokat, amelyek bevonják a súrlódást. Az akció a súrlódási erők vezet hőtermelés, (azaz, a nagyobb teljesítmény mikroszkopikus mozgását részecskék a test és a környezet), és a folyamat már nem tisztán mechanikus. Ez a folyamat spontán módon zajlik. Más a helyzet a fordított folyamat. Vissza a rendszer az eredeti állapotába az szükséges, hogy a test ismét mozgásba az energiát során felszabaduló hűtő és a környezetre. A tapasztalat azt mutatja, hogy a véletlenszerű részecskék mozgását a szervezet nem képes spontán okozhat a szabályos mozgását a részecskék egészére. Ehhez a folyamathoz szükség van egy kiegészítő úgynevezett kompenzáló folyamat. Ezt a folyamatot kell lennie, hogy a test és a hűtőközeg a kezdeti hőmérséklet, azaz a abban, hogy megadja bármely más test hőt és a Bizottság munkáját a szervezetben. Így, bár az eredmény közvetlen rendszer és inverz feldolgozza test környezettel, és visszatért a kezdeti állapot, az állam a külső szervek változik. Következésképpen: minden folyamat kíséri súrlódás visszafordíthatatlan.
A folyamat a hőátadás két test között különböző hőmérsékleteken vezet kiegyenlítését az átlagos energia a termikus a részecskék mozgását a két test, azaz a egyenletes hömérsékletet Tel.
Ez a folyamat spontán amint előírt hőérintkezés szervek között. Más a helyzet a fordított folyamat - fűtés a test hűtéssel egy másik. Spontán, ez a folyamat nem megy végbe. Végrehajtásához szükséges használni hűtőgép, akiknek munkája kapcsolódik a változás állapotának egyéb külső szervek. Ezért: a hőcserélő folyamat a végső hőmérséklet-különbség is visszafordíthatatlan.
Analóg módon meg tudjuk mutatni visszafordíthatatlan oldódás diffúzió.
Egy példa a reverzibilis folyamat lehet csillapítatlan rezgések elkötelezett függesztett test egy tavaszi vákuumban. Egy idő után egyenlő az időszak az a rendszer állapotának perzisztens oszcillációk. Egy idő után egyenlő az időszak az oszcilláció a rendszer állapota ismételni. mert izolált rendszerben bekövetkező változások nem változik az állam más szervek. Így ez a folyamat reverzibilis. A termodinamika, ha bebizonyosodik, hogy a szükséges és elégséges feltétele a reverzibilis folyamat termodinamikai egyensúly.
Ha a koordináta-tengelyek késleltetheti értékek bármely két paraméter bármely egyensúlyi állapotában a rendszer által képviselt pont a koordináta síkon (lásd. Pl tochku1na ábra. 14). Egyensúlyi állapot nem jelenik meg ilyen módon, mert legalább az egyik paraméter nem lesz olyan egyensúlyi állapotban meghatározott lennogo értékeket.
Minden folyamat, azaz. E. Az átmenet egyik állapotból a másikba, sérti a egyensúlyt. Következésképpen, míg folyik a rendszer-ka bárki folyamat megy keresztül szekvenciája neravnove-derék-CIÓ. Utalva a már tárgyalt eljárási gáz kompressziós egy edényben, egy dugattyúval van lezárva, arra a következtetésre juthatunk, hogy egy megsértése-RAV az egyensúly, amikor a dugattyú elmozdul, a jelentősebb készül gyorsabb, mint a gáz kompressziós. Ha a dugattyú lassan, az egyensúlyi elromlott, és a nyomás kissé időben CIÓ pontok alig különbözik néhány átlagos znacheniyar.V határt, ha a gáz összenyomódik végtelenül lassan, gáz minden alkalommal lesz jellemző lennym meghatározott nyomás értéket. Következésképpen, ebben az esetben a CO-álló gázt minden egyes időpontban egy egyensúlyi, és végtelenül lassú folyamat sorozatából állnak, Áramlási sebesség egyensúlyi állapotok, lásd. 14. ábra.
Az eljárás abból áll, egy folytonos szekvencia egyenlő-egyensúlyi állapot az egyensúlyi vagy kvázi-zistaticheskim. Ebből az következik, hogy az egyensúly csak akkor lehet végtelenül lassú folyamat.
Minden valós folyamatok nem egyensúlyi. Előfordulnak olyan véges sebességgel, de néhány esetben a nem egyensúlyi jellege reálfolyamatok lehet hanyagolni (annál lassabb a folyamat játszódik le, így közelebb van az egyensúlyi).
Abban kellően alacsony áramlási reálfolyamatok közelíthetjük tetszőlegesen közel van az egyensúlyhoz szükséges.