Adiabatikus (adiabatikus) folyamat, fizika
Izoterm, izochor és izobár izoprotsessy széles körben használják a mérnöki. Így a törvény Gay-Lussac-törvény az alapja a szerkezet gáz hőmérők; Charles' törvény »működik« egy eszköz, úgynevezett autoklávban, és így tovább. N. Termodinamika vizsgálatok egy másik eljárás, amelyet széles körben használják a gyakorlatban, különösen hő motorok. Ez az úgynevezett adiabatikus folyamat.
Adiabatikus folyamat- egy termodinamikai folyamat, amely egy hőszigetelő rendszer, azaz a hiányában hőcsere a környező szervekkel.
Mivel ebben az esetben a Q = 0, akkor összhangban az első főtétele, minden munkát végzünk a változás a belső energia a rendszer: A = Au.
Természetesen reálértékben, hogy egy ilyen eredmény gyakorlatilag lehetetlen, mert nincs tökéletes hőszigetelést. De megközelíteni ezt a hipotézist több szempontból is. Például, hogy hozzon létre egy shell rossz hővezető (egy termosz), vagy elvégzi a folyamat olyan gyorsan, hogy a hőcserélő a rendszer és a környező szervek rövidek voltak, és azok is elhanyagolhatók.
Ha adiabatikus kompresszió a gáz összes elvégzett munka az, hogy növelje a belső energia a test: A = δU.Pri adiabatikus gazaA „= -δU, azaz a gáz végez munkát csökkentésével belső energiája.
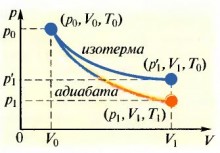
Ábra. 2.5. Grafikus ábrázolása ADIA baht
Például, a gyors összenyomó a gáz növekedést okoz a belső energia, amely megegyezik a száma végrehajtott munka A, és a gáz melegítjük. Ez a jelenség különösen öngyulladás a tüzelőanyag-keverék van kialakítva dízelmotorok. Ezzel szemben, ha a gáz nem végez munkát, mivel a gyors terjeszkedés, a belső energia csökken, a gáz hőmérséklete lecsökken. Ez a tulajdonság az adiabatikus folyamat alapjául gázcseppfolyósító. Egy példa az adiabatikus folyamat is egy robbanás, megolvasztjuk a biztosíték alatt rövidzárlat és így tovább. N.
Grafikusan egy koordinátarendszerben pV adiabatikus folyamat képviseli egy görbe nevű adiabatikus (ábra. 2.5). Ő esik meredekebb, mint az izoterma, mivel az adiabatikus folyamat a nyomás változása miatt van egyidejű volumenének növekedése és a hőmérséklet csökkenés. Ezt a következtetést megerősíti a általános képletű (24): p = NKT, mert térfogatának növekedését a gáz csökkenéséhez vezet a gáz koncentrációja molekulák, és így csökkentik nyomás hatására a két paraméter - a gáz hőmérséklete a T és a molekulák koncentrációja n.
Mivel adiabatikus tágulása a gáz történik változás az állapota, amelyet az jellemez, csökken a belső energia; adiabatikus kompresszió a gáz belső energiája nő.
Ezen az oldalon az anyag a témában: