Adiabatikus folyamat - studopediya
4. Az adiabatikus folyamat. Ha az edényt expandáló gáz szigetelve a környezet, akkor nem lesz hőcserélő, azaz. E. Q = 0. A folyamat, amely akkor jelentkezik, amikor ez a feltétel nevezik adiabatikus.
Termodinamika első főtétele egyenlet figyelembevételével állapot Q = 0 prini néző maet
0 = # 916; U + A vagy A = - # 916; U. (109)
Következésképpen, adiabatikus folyamat munkát csak a rovására a belső energia a gáz. Egy adiabatikus gáz működik, és a belső energia, és ezért a hőmérséklet csökkenése. Ha adiabatikus kompressziós munkát a gáz negatív (a környezet működik a gáz), a belső energia és a gáz hőmérséklete nő.
Adiabatikus folyamat megvalósítható lényegében hiányában a jó hőszigetelés. De akkor van szükség, ha az eljárást olyan gyorsan, hogy annak végrehajtása során nem történt olyan jelentős hőcsere a külső környezet.
A fajhő egy adiabatikus folyamat
Levezetjük az egyenlet a görbe mutatja az adiabatikus folyamat RV- diagram. Az egyenlet a gáz állapotban mól rendelkezik formájában
Amikor egy infinitezimális változás az állam által végzett munka A = PDV, és a változás a belső energia szerinti (83), # 916; U -> CV dT. Behelyettesítve ezeket az értékeket az A és # 916; U az egyenletben az első főtétele (109), ezt kapjuk:
Ez az adiabatikus egyenlet differenciális formában. Mivel ez tartalmazza mindhárom paraméter - P, V és T, - a kizárás egyikük vehetik a állapotegyenlet (111) pre-differenciáló neki
PDV + VDP = RDT. (113)
Szorzás egyenlet (112) az R, és (113) - a saját CV iskladyvaya kapjunk
Figyelembe véve, hogy egy ideális gáz CV + R = = Cp, szakadék egyenlet (114) által a termék CV pV és bevezetni a jelölést
Ekkor (114) formáját ölti
Figyelembe véve, hogy az állandó tényező # 947; tudod, hogy a differenciál jel transzformáció (116) a forma
d [# 947; LNV + LNP] = 0. (117)
Ebből következik, hogy az a mennyiség, zárójelben, állandónak kell lennie. Jelöljük az állandó ln (const). majd
# 947; LNV + LNP = ln (const). (118)
feltéve, hogy # 947; LNV = LNV # 947; és potenciáló expresszióját (118), megkapjuk
pV # 947; = Const. (119)
Ez az adiabatikus egyenlet. Úgy is nevezik, a Poisson-egyenlet.
mint # 947;> 1 a görbét, amely ez az egyenlet (. 39. ábra) meredekebb, mint az izotermák pV = const. amely összehasonlítást mutatja az ábra mutatja a szaggatott vonalak között. Úgy látszik, hogy alá esik az izoterma, t. E. A gáz lehűl, és az adiabatikus kompressziós görbe (119) fölé emelkedik az izoterma, t. E. A gáz fűtése adiabatikus tágulása a pontot a görbe I (119). A mennyiség a működése adiabatikus folyamat különösen egyszerűen egyenlet alkalmazásával számítottuk ki (109):
A képlet (115), egyenlet (120) lehet átalakítani, hogy:
Ahhoz, hogy megtalálja a végső hőmérséklet T2 lehetséges, hogy (111) és (119), hogy megkapjuk a kapcsolatban
tv # 947; -1 = const. (122)
Az egyatomos gázok Cv = 12,5 kJ / (kmól * K), CP = CV + R = 20,8 kJ / (kmól * K), és adiabatikus exponens egyenlő körülbelül 1,67. A kétatomos gázok közönséges hőmérsékleten. Mert poliatomos gázok gerjesztve rezgési szabadsági fok a hőkapacitása CP és Cv még nagyobb értéket és adiabatikus kitevő
még közelebb egységét.
A nagy sebességű belső égésű motorok és a lejárati gázok a fúvókán keresztül jet gáz expanziós folyamat akkor történik, olyan gyorsan, hogy lehet tekinteni, mint gyakorlatilag adiabatikus és egyenlettel számoljuk ki (119).
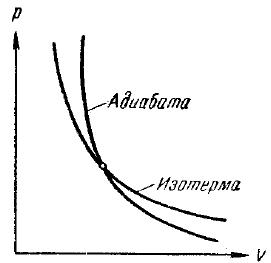
Ábra. 39. Az adiabatikus és izoterm
Mivel y> 1, akkor (122), amely során adiabatikus kompresszió a gáz melegítjük, és egy adiabatikus - lehűtjük. Ez a jelenség találja alkalmazás dízelmotorok, ahol gyújtása éghető keverék végzi adiabatikus kompresszió. fűtés a gáz adiabatikus kompresszió annak a ténynek köszönhető, hogy közben a kompresszió által termelt gáz munka folyik, hogy növelje belső energia. És mivel a belső energia az ideális gáz csak attól függ a hőmérséklettől, ez a növekedés a belső energia nyilvánul emelkedhet a hőmérséklet. Hasonlóan magyarázható és a gáz hűtése adiabatikus expanzió. Hűtés a gáz adiabatikus használják hűtőgépek.